мһ„мһ¬кҙҖ newsmedical@daum.net
мӢқн’Ҳмқҳм•Ҫн’Ҳм•Ҳм „мІҳ(мІҳмһҘ мҳӨмң кІҪ)к°Җ 12мӣ” 27мқј вҖҳнҳҲм•Ўм ңм ң мӢ¬мӮ¬мһҗлЈҢ мһ‘м„ұ мӢң кі л ӨмӮ¬н•ӯвҖҷкіј вҖҳнҳҲмһҘ분нҡҚм ңм ң мһҗк°Җ кё°мӨҖ л°Ҹ мӢңн—ҳл°©лІ• мһ‘м„ұ н•ҙм„Өм„ңвҖҷлҘј к°ңм •В·л°ңк°„н–ҲлӢӨ.

мқҙлІҲ к°Җмқҙл“ңлқјмқёмқҳ мЈјмҡ” лӮҙмҡ©мқҖ в–ІвҖҳнҳҲм•ЎкҙҖлҰ¬лІ• мӢңн–үк·ңм№ҷвҖҷ к°ңм •м—җ л”°лқј 추к°Җлҗң мӢ к·ң нҳҲм•Ўм ңм ң 9к°ң н’ҲлӘ©(лӢӨмў…л°ұнҳҲкө¬м—¬кіјм ңкұ°м„ұ분мұ„нҳҲнҳҲмҶҢнҢҗ, лӢӨмў…м„ұ분мұ„нҳҲнҳҲмһҘ, л°©мӮ¬м„ мЎ°мӮ¬ лҶҚ축м ҒнҳҲкө¬, л°©мӮ¬м„ мЎ°мӮ¬ л°ұнҳҲкө¬м—¬кіјм ңкұ°м ҒнҳҲкө¬, л°©мӮ¬м„ мЎ°мӮ¬ м„ёмІҷм ҒнҳҲкө¬, л°©мӮ¬м„ мЎ°мӮ¬ лҶҚ축нҳҲмҶҢнҢҗ, л°©мӮ¬м„ мЎ°мӮ¬ л°ұнҳҲкө¬м—¬кіјм ңкұ°м„ұ분мұ„нҳҲнҳҲмҶҢнҢҗ, л°©мӮ¬м„ мЎ°мӮ¬ лӢӨмў…л°ұнҳҲкө¬м—¬кіјм ңкұ°м„ұ분мұ„нҳҲнҳҲмҶҢнҢҗ, л°©мӮ¬м„ мЎ°мӮ¬ м„ёмІҷнҳҲмҶҢнҢҗ) л“ұ лҢҖмғҒ н’ҲлӘ© м•ҲлӮҙ, в–ІмӣҗлЈҢм•Ҫн’Ҳ л°Ҹ к·ё 분лҹү, м ңмЎ°л°©лІ• мһ‘м„ұ мҳҲмӢң, в–ІнҳҲм•Ўм ңм ңмқҳ н’ҲлӘ©н—Ҳк°Җ мӢң м•Ҳм •м„ұ мһҗлЈҢ мһ‘м„ұ мҡ”л №, в–ІнҳҲмһҘ분нҡҚм ңм ң мһҗк°Җ кё°мӨҖ л°Ҹ мӢңн—ҳл°©лІ• м„Өм • мӢң к·јкұ°мһҗлЈҢ мў…лҘҳмҷҖ лІ”мң„ л“ұмқҙлӢӨ.
мӢқм•ҪмІҳ нҸүк°Җмӣҗ л°”мқҙмҳӨмғқм•ҪмӢ¬мӮ¬л¶ҖлҠ” вҖңмқҙлІҲ к°Җмқҙл“ңлқјмқёмқҙ нҳҲм•Ўм ңм ң л“ұ н’ҲлӘ©н—Ҳк°Җм—җ н•„мҡ”н•ң мһҗлЈҢлҘј мӨҖ비н•ҳлҠ” лҚ° лҸ„мӣҖмқ„ мӨ„ кІғмңјлЎң кё°лҢҖн•ңлӢӨ.вҖқлқјл©°, вҖңм•һмңјлЎңлҸ„ к·ңм ңкіјн•ҷ м „л¬ём„ұмқ„ л°”нғ•мңјлЎң нҳҲм•Ўм ңм ң л“ұмқҙ мӢ мҶҚн•ҳкІҢ м ңн’Ҳнҷ”лҗ мҲҳ мһҲлҸ„лЎқ м Ғк·№ м§Җмӣҗн•ҳкІ лӢӨ.вҖқлқјкі л°қнҳ”лӢӨ.
н•ңнҺё вҖҳнҳҲм•Ўм ңм ң мӢ¬мӮ¬мһҗлЈҢ мһ‘м„ұ мӢң кі л ӨмӮ¬н•ӯвҖҷ л°Ҹ вҖҳнҳҲмһҘ분нҡҚм ңм ң мһҗк°Җ кё°мӨҖ л°Ҹ мӢңн—ҳл°©лІ• мһ‘м„ұ н•ҙм„Өм„ңвҖҷлҠ” мӢқм•ҪмІҳ лҢҖн‘ңлҲ„лҰ¬м§‘вҶ’лІ•л №/мһҗлЈҢвҶ’лҜјмӣҗмқём•ҲлӮҙм„ңм—җм„ң нҷ•мқён• мҲҳ мһҲлӢӨ.
[메디컬мӣ”л“ңлүҙмҠӨ]
- TAG



 м „көӯ 16к°ң мӢңмһҘ лҶҚ축мӮ°л¬ј 20% н• мқё мӢңлІ”мӮ¬м—… мӢӨмӢң
м „көӯ 16к°ң мӢңмһҘ лҶҚ축мӮ°л¬ј 20% н• мқё мӢңлІ”мӮ¬м—… мӢӨмӢң
 [м№ҳкіјм—җ лҢҖн•ң лӘЁл“ кІғ]мқјл°ҳм Ғ м№ҳм•„көҗм •кіј м•һлӢҲ лҜёлӢҲкөҗм •мқҳ м°Ёмқҙм җкіј нҠ№м§•мқҖ?
[м№ҳкіјм—җ лҢҖн•ң лӘЁл“ кІғ]мқјл°ҳм Ғ м№ҳм•„көҗм •кіј м•һлӢҲ лҜёлӢҲкөҗм •мқҳ м°Ёмқҙм җкіј нҠ№м§•мқҖ?
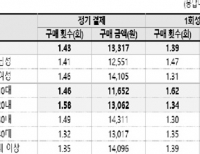 м•ұ к°ңл°ңмһҗ "мқём•ұкІ°м ң к°ҖмһҘ нҒ° л¬ём ңлҠ” кіјлҸ„н•ң мҲҳмҲҳлЈҢ"
м•ұ к°ңл°ңмһҗ "мқём•ұкІ°м ң к°ҖмһҘ нҒ° л¬ём ңлҠ” кіјлҸ„н•ң мҲҳмҲҳлЈҢ"