к№ҖмҳҒмӢ medicalkorea1@daum.net
мң лӢҲл©”л“ңм ңм•Ҫ(лҢҖн‘ң к№ҖкұҙлӮЁ)мқҙ мқјнҡҢмҡ© мқёкіөлҲҲл¬ј м җм•Ҳм ң вҖҳмӣҗнғҖмһ„н”„л Ҳмү¬м җм•Ҳм•ЎвҖҷ (Carboxymethylcellulose sodium 0.5%)мқҳ лҜёкөӯ мҲҳм¶ңмҡ© м ңн’Ҳкіј кҙҖл Ён•ҙ лҜёкөӯ FDAлЎңл¶Җн„° мӢӨмӮ¬лҘј л°ӣм•ҳмңјл©° мөңк·ј м„ұкіөм ҒмңјлЎң нҶөкіјн–ҲлӢӨкі л°қнҳ”лӢӨ.
мң лӢҲл©”л“ңм ңм•ҪмқҖ к·ёлҸҷм•Ҳ м•Ҫ 10нҡҢ к°Җлҹү мҲҳмҡ”мһҗмёЎмңјлЎңл¶Җн„° GMP мӢӨнғңмЎ°мӮ¬лҘј 비лЎҜн•ң л…ёл¬ҙ, ліҙм•Ҳ, нҷҳкІҪ л“ұ лӢӨм–‘н•ң 분야мқҳ мӢӨмӮ¬мҷҖ кІҖмҰқмқ„ л°ӣм•„мҷ”мңјл©°, м§ҖлӮң 2017л…„ 8мӣ”м—җлҠ” мң лҹҪ 진мһ…мқ„ мң„н•ң CE л§ҲнҒ¬лҘј нҡҚл“қн•ң л°” мһҲлӢӨ.
нҠ№нһҲ мқҙлІҲ лҜёкөӯ FDA нҶөкіјлҠ” мөңк·ј мқјл¶Җ көӯлӮҙ м ңм•ҪмӮ¬л“Өмқҙ лҜёкөӯ FDA кІҪкі л°Ҹ л¶Җм Ғн•© л“ұ л¶Җм •м Ғмқё мӮ¬лЎҖк°Җ л№ҲлІҲн•ң к°ҖмҡҙлҚ° лӮҳнғҖлӮң кІ°кіјлЎң лҲҲкёёмқ„ лӘЁмңјкі мһҲлӢӨ.
мң лӢҲл©”л“ңм ңм•Ҫ кҙҖкі„мһҗлҠ” вҖңмқҙлІҲ лҜёкөӯ FDA мӢӨмӮ¬лҠ” м ңмЎ°мӢңм„Ө, м„Ө비, л¬ём„ң, мқёл Ҙ л“ұ лӘЁл“ л©ҙм—җм„ң мҷ„лІҪм—җ к°Җк№Ңмҡҙ нҸүк°ҖлҘј м–»м–ҙлғҲлӢӨвҖқл©°, вҖңн•ҙлӢ№ м ңн’Ҳмқҳ м•Ҳм •м Ғмқё кіөкёүлҝҗ м•„лӢҲлқј н–Ҙнӣ„ мқҙм–ҙм§Ҳ нӣ„мҶҚ м ңн’Ҳл“Өмқҳ лҜёкөӯ 진м¶ңм—җлҸ„ кёҚм •м Ғмқё мІӯмӢ нҳёк°Җ мјң진 м…Ҳмқҙ лҗҗлӢӨвҖқкі л°қнҳ”лӢӨ.
лҳҗ вҖңкіјкұ° лҜёкөӯ л“ұ м„ м§„көӯм—җ лҢҖн•ң мҲҳм¶ң мқҙлҜём§ҖлҠ” л°•лҰ¬лӢӨл§Ө м „лһөмңјлЎң м№ҳл¶Җлҗң л©ҙмқҙ м—Ҷм§Җ м•Ҡм§Җл§Ң, лӘ…мӢӨкіөнһҲ CGMPмҷҖ CE к·ңм •мқ„ кіөнһҲ 충мЎұмӢңнӮӨлҠ” мҷ„лІҪн•ң м ңмЎ°нҷҳкІҪмқ„ кө¬м¶•н–ҲлӢӨвҖқл©°, вҖңмқҙлҘј нҶөн•ҙ л§Ңл“Өм–ҙ진 мөңкі мқҳ н’Ҳм§Ҳмқё л§ҢнҒј н–Ҙнӣ„ мӢңмһҘм—җм„ңлҸ„ н•©лӢ№н•ң мҲҳмӨҖмқҳ к°Җм№ҳ нҡҚл“қмқҙ к°ҖлҠҘн• кІғмңјлЎң кё°лҢҖлҗңлӢӨвҖқкі л°қнҳ”лӢӨ.
н•ңнҺё мң лӢҲл©”л“ң мҳӨмҶЎкіөмһҘмқҖ м§ҖлӮң 2017л…„ 4мӣ” мІ« м„ м Ғмқ„ мӢңмһ‘н•ң нӣ„ нҳ„мһ¬к№Ңм§Җ м§ҖмҶҚм Ғмқҙл©° м•Ҳм •м Ғмқё м ңн’Ҳ кіөкёүм—җ м—ӯм җмқ„ л‘җм—Ҳмңјл©°, кұ°лһҳл¬јлҹүлҸ„ мғҒлӢ№н•ң мҲҳмӨҖм—җ лҸ„лӢ¬, м§ҖлӮң 5мӣ” 8мқјл¶Җн„° 7мқјк°„ вҖҳмӣҗнғҖмһ„н”„л Ҳмү¬м җм•Ҳм•ЎвҖҷм—җ лҢҖн•ҙ лҜёкөӯ FDAлЎңл¶Җн„° 집мӨ‘м Ғмқё мӢӨмӮ¬лҘј л°ӣм•ҳлӢӨ.



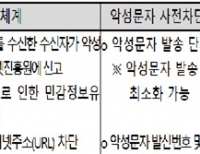 м•…м„ұл¬ёмһҗ мӮ¬м „м°ЁлӢЁ м„ң비мҠӨ мӢңлІ” мҡҙмҳҒ
м•…м„ұл¬ёмһҗ мӮ¬м „м°ЁлӢЁ м„ң비мҠӨ мӢңлІ” мҡҙмҳҒ