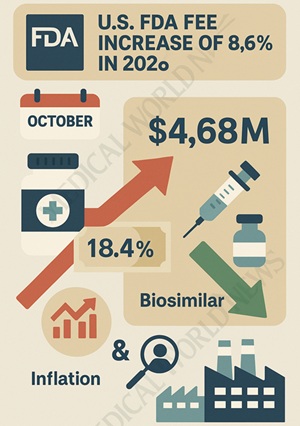
미국 FDA가 지난 7월 30일 2026 회계연도(2025년 10월~2026년 9월) 허가심사수수료를 확정 발표하며, 전문의약품 수수료를 기존 431만 달러에서 468만 달러(약 65억원)로 8.6% 인상한다고 밝혔다.
◆ 전문의약품·제네릭 수수료 대폭 인상
FDA는 매년 인플레이션율, 심사 신청건수 변화, 제조시설 수 증가, 심사자 고용 및 유지비용 등을 종합적으로 고려해 이용자부담금을 책정하고 있다.
이번 인상은 물가상승과 심사 업무량 증가에 따른 불가피한 조치로 분석된다.
2026년도 전문의약품 허가심사수수료는 임상자료 포함 시 468만 달러, 임상자료 불포함 시 234만 달러로 각각 8.6% 인상됐다.
제네릭의약품(ANDA)은 35만 8,000달러로 11.3% 오르며 가장 큰 인상폭을 보였다. 의료기기 관련 수수료도 7.1% 인상될 예정이다.
FDA는 2026년도 전문의약품 프로그램을 2,971개로 추정하고 있으며, 이 중 156개가 희귀의약품 등으로 수수료 면제 혜택을 받을 것으로 예상된다고 밝혔다.
◆ 바이오시밀러만 예외적 인하
반면 바이오시밀러 허가심사수수료는 18.4% 대폭 인하된다.
임상자료 포함 시 147만 달러에서 120만 달러로, 임상자료 불포함 시 73만 달러에서 60만 달러로 각각 낮아진다.
이는 바이오시밀러 시장 활성화를 위한 FDA의 정책적 배려로 해석된다.
바이오시밀러 개발을 위한 FDA와 기업 간 공식 미팅 프로그램인 BPD(Biological Product Development) 건수도 2025년 120개에서 2026년 150개로 25% 증가할 것으로 전망된다.
◆ 제약업계 비용 부담 가중 우려
새로운 수수료 체계는 오는 10월 1일부터 적용되며, 국내 제약바이오기업들의 미국 진출 비용 부담이 더욱 커질 것으로 예상된다.
특히 전문의약품과 제네릭의약품 분야에서 허가 신청을 준비 중인 기업들은 추가 비용을 고려한 사업 계획 재검토가 필요할 전망이다.
한국바이오협회 관계자는 “FDA 수수료 인상이 지속되면서 중소 제약기업들의 미국 시장 진출 장벽이 높아지고 있다”며 “정부 차원의 지원 방안 마련이 시급하다”고 지적했다.
한편 이번 수수료 조정은 FDA의 허가심사 역량 강화와 신속한 승인 절차 운영을 위한 재원 확보 차원에서 이뤄졌으며, 향후 제약바이오산업의 글로벌 경쟁력에 미치는 영향을 주목해야 할 것으로 보인다.
[메디컬월드뉴스 김영신 기자]
다른 곳에 퍼가실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
 http://www.medicalworldnews.co.kr/news/view.php?idx=1510969183
http://www.medicalworldnews.co.kr/news/view.php?idx=1510969183