식품의약품안전처(처장 이의경)가 지난 11월 29일 ‘생물학적제제등 제조 및 품질관리기준 해설서’ 개정·발간했다.
바이오의약품 분야 제조·품질관리기준(GMP) 업무 이해에 도움을 주기 위해 발간한 이번 해설서는 바이오의약품 제조·품질관리(GMP) 관련 규정의 개정사항을 반영하고, 미국 규정을 참고사항으로 제시해 이해를 돕도록 했다.
주요 내용은 ▲생물학적제제, 세포치료제, 유전자치료제의 정의 설명 ▲병원체 종류별 전용 작업실에 대해 추가 설명 등으로 현장에서 유용하게 사용할 수 있도록 했다.
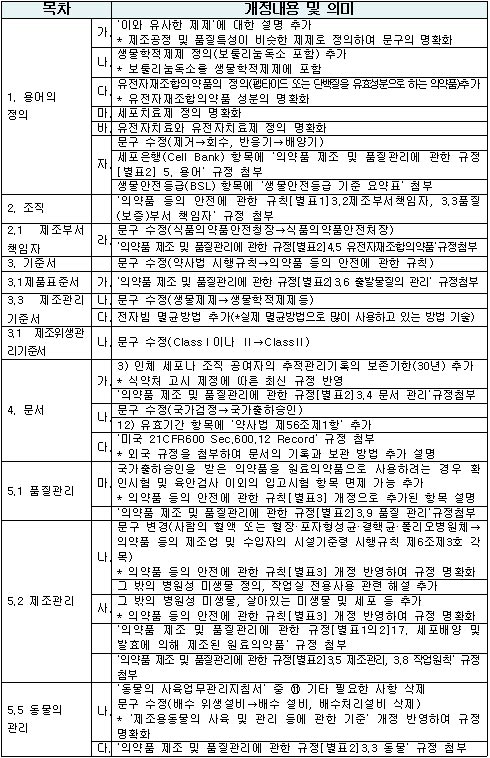
(표)세부 개정 내용
식약처 바이오생약국 바이오의약품품질관리과는 “이번 해설서 개정으로 관련 업계에서 바이오의약품 제조·품질관리기준을 명확하게 이해하여 안전과 품질이 확보된 바이오의약품을 제조하고, 정부와 업계의 눈높이를 맞추어 제도 운영의 투명성이 강화될 것”으로 전망했다.
한편 이번 해설서는 (식약처 홈페이지 > 법령/자료 > 법령정보 > 공무원지침서/민원인안내서)에서 확인할 수 있다.
[메디컬월드뉴스]
다른 곳에 퍼가실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
 http://www.medicalworldnews.co.kr/news/view.php?idx=1510933350
http://www.medicalworldnews.co.kr/news/view.php?idx=1510933350