식품의약품안전처(처장 오유경)가 지난 12월 28일 ‘의약품 제조 및 품질관리에 관한 규정’(식약처 고시)을 개정해 무균의약품의 오염관리 절차 강화를 했다.
이번 개정 고시 주요 내용은 다음과 같다.
(표)개정 주요 내용 및 시행일
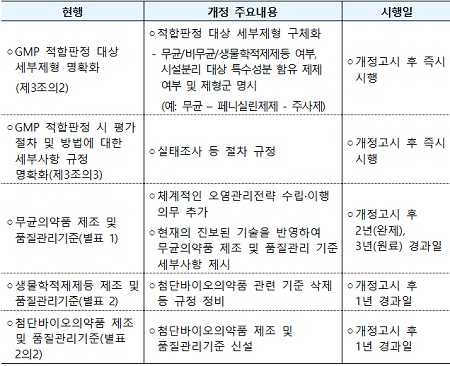
◆무균의약품 제조를 위한 체계적인 오염관리전략 수립·이행 의무 추가
주사제 등 무균의약품의 관리 수준을 높이는 차원에서 업체가 제조 시 체계적인 오염관리전략을 수립·이행하도록 의무화했다.
또한 무균의약품 제조·품질관리기준(GMP)을 현재의 최신 기술수준에 맞춰 현행화하고 이에 따른 적용 사례를 구체적으로 제시했다.
식약처는 “이번 개정 사항을 제도의 안정적인 도입과 업계의 준비기간을 고려해 무균완제의약품의 경우 시행일로부터 2년, 무균원료의약품의 경우 3년 이내에 적용하도록 했다.”라고 설명했다.
◆첨단바이오의약품 개별 제조·품질관리기준(GMP) 마련
첨단바이오의약품의 안전관리를 강화하고, 급변하는 기술 상황을 신속히 규제기준에 반영하기 우해 현행 생물유래의약품 제조·품질관리기준(GMP) 중에서 첨단바이오의약품 관련 내용을 분리해 별도의 제조·품질관리기준(GMP)을 신설했다.
식약처는 이번 개정 사항을 제도의 안정적인 도입과 업계의 준비기간을 고려해 시행일로부터 1년 이내에 적용하도록 했다.
◆제조·품질관리기준 적합판정 대상 세부제형, 판정 절차·방법 세부사항 명확화
제조·품질관리기준(GMP) 적합판정제 제도 운영에 대한 투명성을 확보하고 업계의 이해도를 향상시키기 위해, 그간 운영해왔던 제조·품질관리기준(GMP) 적합판정 대상 세부제형 선정 원칙을 구체적으로 기술하고 적합판정 시 보완이나 실태조사 등 절차·방법에 대한 세부사항을 명확히 규정했다.
식약처 의약품안전국은 “이번 개정이 국내 의약품 품질보증 수준을 높이고 국민 보건을 향상시키는 데 도움이 될 것으로 기대한다.”라며, “앞으로도 K-의약품의 국제 경쟁력을 강화하고 수출을 지원하기 위해 의약품 제조·품질관리기준(GMP) 체계를 합리적·적극적으로 정비·운영하겠다.”라고 밝혔다.
한편 이번 개정 고시의 세부 내용은 식약처 대표 누리집 → 법령·자료 → 법령정보 → 제·개정고시등 또는 법제처 국가법령정보센터에서 확인할 수 있다.
[메디컬월드뉴스]
다른 곳에 퍼가실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
 http://www.medicalworldnews.co.kr/news/view.php?idx=1510959035
http://www.medicalworldnews.co.kr/news/view.php?idx=1510959035