식품의약품안전처(처장 오유경)가 백신 등 국가출하승인 의약품을 대상으로 매년 ‘위해도 기반 평가’를 수행해 품질에 대한 일관성이 확보된 제품은 시험 항목을 간소화하고, 면밀한 품질 평가가 필요한 제품은 철저하게 시험하여 검증하고 있다.
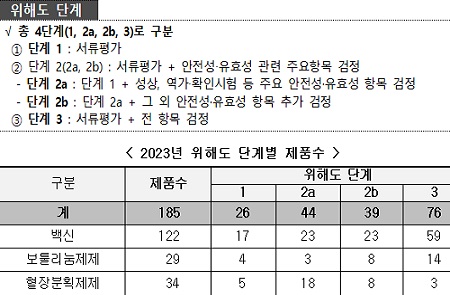
총 185개 제품(백신 122개, 보툴리눔 제제 29개, 혈장분획제제 34개 제품)에 대해서 ‘위해도 기반 평가’ 결과 위해도 단계 1은 26개 제품(14%), 단계 2(2a, 2b)는 83개 제품(45%), 단계 3은 76개 제품(41%)으로 분류했다.
식약처는 2023년 4월 1일부터 2024년 3월 31일까지 국가출하승인을 신청한 민원에 대하여 이번 위해도 평가 결과를 적용할 예정이다.
식약처 바이오생약심사부는 “앞으로도 전문성과 규제과학을 바탕으로 제품의 품질에 영향을 주는 요소 등을 종합적으로 평가하여 국민이 안심하고 국가출하승인 대상 의약품을 사용할 수 있도록 최선을 다하겠다”고 밝혔다.
[메디컬월드뉴스]
다른 곳에 퍼가실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
 http://www.medicalworldnews.co.kr/news/view.php?idx=1510954897
http://www.medicalworldnews.co.kr/news/view.php?idx=1510954897