식품의약품안전처(처장 이의경)가 코오롱생명과학 인보사케이주에 대한 상세한 조사결과를 소개했다.
식약처는 그동안 진행경과는 물론 자체 시험결과와 코오롱생명과학이 제출한 자료에 대한 검토결과, 미국 현지실사 결과 등도 소개했다.
이에 대한 구체적인 조사결과는 다음과 같다.
◆식약처 자체 시험검사 결과
▲유전자검사(STR, Short Tandem Repeat : DNA 비교·분석 통해 같은 계통의 세포임을 확인) : 2019.4.9~5.9
2액의 유전학적 계통검사를 통해 신장세포 유래 여부를 확인하기 진행한 검사결과 2액은 연골세포가 아닌 신장세포 유래로 확인됐다.
▲gag․pol PCR(Polymerase Chain Reaction : 유전자를 증폭하여 특이 유전자 존재 여부 확인) 시험 : 2019.4.25~5.13
2액에서 신장세포 특이 유전자인 gag․pol 존재 여부 확인을 위한 목적으로 진행한 시험 결과 2액의 마스터세포은행, 제조용세포은행 및 제품 모두에서 gag․pol 유전자가 확인됐다.
▲ TGF-β1 PCR 시험 : 2019.4.12~4.16
2액 세포에 삽입한 TGF-β1 유전자 존재 여부 확인을 위한 목적으로 진행한 시험결과 2액 세포에 삽입한 TGF-β1 유전자 존재가 확인됐다.
▲세포사멸시험 : 2019.4.11~5.26
방사선 조사된 2액의 세포가 배양 개시 후 44일째 완전히 사멸하는지 여부를 확인하기 위해 실시한 시험 결과 세포가 44일째 완전히 사멸됨을 확인했다.
◆코오롱생명과학이 제출한 자료에 대한 검토결과
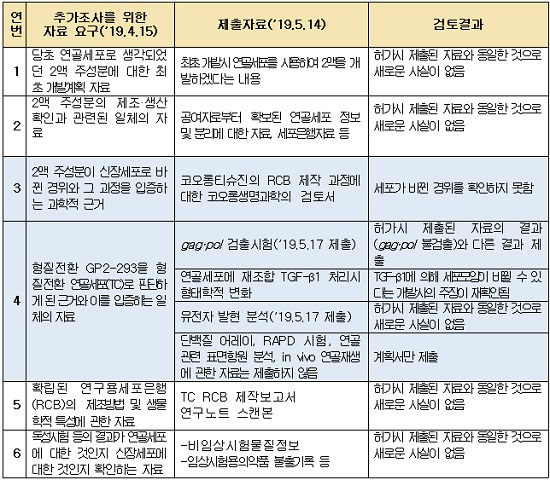
코오롱생명과학은 2액이 바뀐 경위 및 이유에 대한 과학적 근거를 제시하지 못했으며, 2액이 연골세포임을 증명하는 재검증 자료도 제출하지 못했다.
특히 허가시 연골세포임을 증명하는 주요 자료로 사용된 단백질 발현 비교분석자료(단백질어레이)와 신장세포 특이적 유전자(gag․pol)의 불검출 자료는 허위로 밝혀졌다.
◆미국 현지실사(2019.5.20∼24) 결과
▲‘2액의 유전자 삽입위치 분석결과’가 허가신청시 제출자료와 다름 확인
코오롱티슈진은 2액에 삽입된 TGF-β1 유전자를 유전체염기서열(Whole Genome Sequencing)로 분석한 결과, 허가 신청 시 제출된 결과와 유전자 삽입개수 및 위치가 다른 사실(14개→35개)을 확인(2016.10)하고도 이를 식약처에 제출하지 않았다.
코오롱티슈진은 해당 내용에 대해 코오롱생명과학에 중간 결과를 통보함(2016.7)
▲허가신청시 제출한 gag․pol PCR 시험결과에 대한 신뢰성 부족
2액에 대한 gag․pol PCR 시험 관련 연구노트 등을 확인한 결과, 코오롱티슈진은 허가신청 전 장기간 반복실험(2003.10~2005.3)에서 gag․pol이 검출되는 경우가 있었음에도 이에 대한 원인조사(신장세포 오염 등 검토) 없이 불검출 결과만 선별해서 허가자료로 제출했음을 확인했다.
▲개발초기 2액이 신장세포로 바뀐 경위 확인 불가
연구용세포은행의 제조과정에 대한 연구노트 확인결과, 수행 시험의 제목 및 날짜만 기록되어 있고 자세한 제조과정 등은 확인할 수 없었다.
또 제조과정 관련한 바이러스 감염, 세포선별, 오염여부 검증 등에 대한 SOP 또는 실험실 매뉴얼을 확인할 수 없었다.
▲코오롱티슈진이 신장세포를 인지한 시점 확인
코오롱티슈진은 2017년 4월 5일 위탁제조소로부터 2액이 신장세포로 확인되었다는 검사결과를 받아 2017년 7월 13일에 코오롱생명과학에 e-mail로 송부했다.
검사기관 → 위탁제조소(2017.3.13) → 코오롱티슈진(2017.4.5) → 코오롱생명과학(2017.7.13)
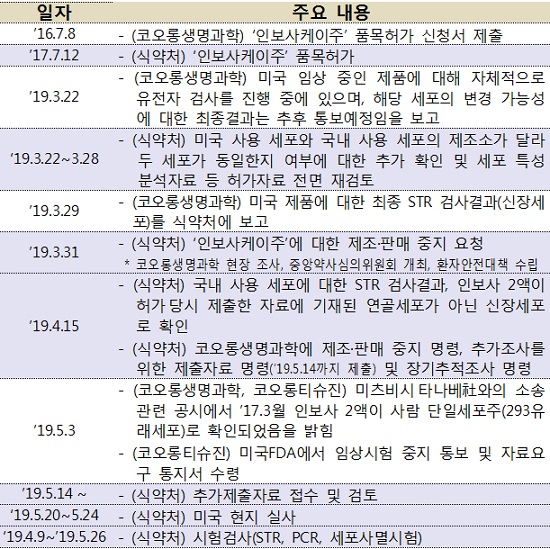
◆그간 경과
[메디컬월드뉴스 김영신 기자]
다른 곳에 퍼가실 때는 아래 고유 링크 주소를 출처로 사용해주세요.
 http://www.medicalworldnews.co.kr/news/view.php?idx=1510930931
http://www.medicalworldnews.co.kr/news/view.php?idx=1510930931